3 Resumo de contidos
-
Gases. Non teñen forma nin volume fixos. As moléculas dos gases están en continuo movemento, batendo entre elas e contra as paredes. A presión dos gases é debida a estes choques.
-
Lei dos gases
-
Se a temperatura non varía: P1V1 = P2V2
-
Se o volume é constante:

-
Se a presión é constante:
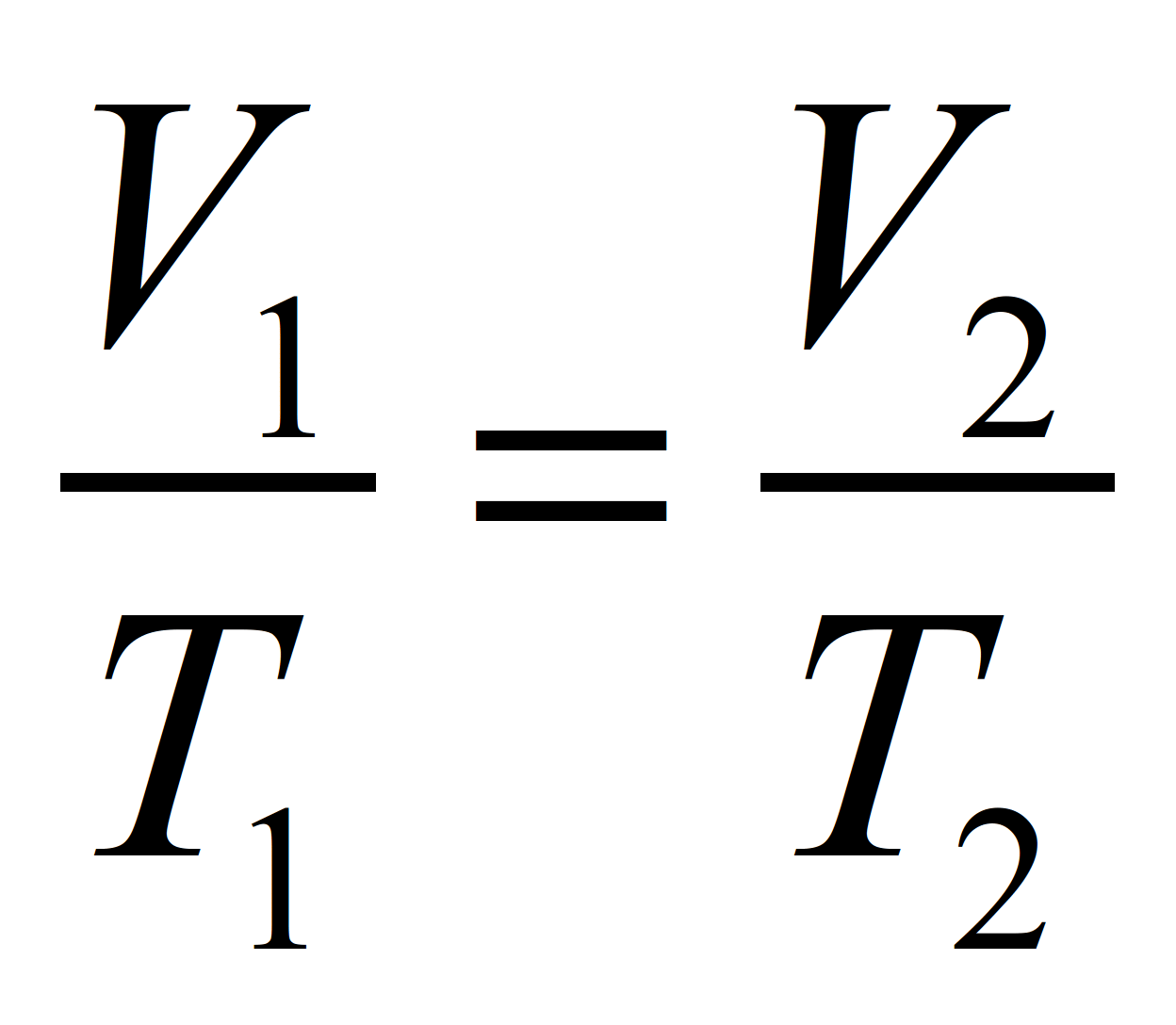
Lembre que a temperatura hai que póla en kelvins: TK = TC + 273
-
Líquidos e sólidos. Os átomos e as moléculas están neles moi próximos, por iso non reducen o seu volume cando os comprimimos.
-
Cambios de estado de agregación. Podémolos explicar usando o modelo cinético da materia.
-
Modelos atómicos.
-
Dalton: esferas macizas sen cargas eléctricas.
-
Thomson: esfera maciza de carga positiva con electróns negativos incrustados e espallados pola esfera (modelo sandía).
-
Rutherford: o átomo ten un núcleo diminuto con protóns positivos. Arredor do núcleo móvense os electróns, como os planetas arredor do sol.
-
Modelo de orbitais: o átomo ten un núcleo diminuto con protóns positivos e neutróns e arredor do núcleo móvense os electróns. Non podemos saber con certeza a posición do electrón nin a súa traxectoria, soamente a probabilidade de atopalo nun lugar determinado arredor do núcleo.
-
Número atómico (Z): é o número de protóns que hai no núcleo.
-
Número másico (A): é o número de protóns máis de neutróns do núcleo.
-
Isótopos: núcleos que teñen igual número atómico e diferente número másico.
-
Elemento químico: substancia formada por átomos con igual número atómico. Exemplos: O2, P4, Al, S8.
-
Composto químico: substancia formada por dous ou máis elementos. Exemplos: H2O, C6H12O6.
-
Enlace químico: é a unión entre átomos (iguais ou diferentes).
-
Enlace iónico:
-
Fórmase entre un metal e un non metal.
-
O metal cédelle electróns ao non metal.
-
O átomo do metal convértese nun catión positivo, o non metal nun anión negativo.
-
Fórmase un composto químico, nunca un elemento.
-
Os ións organízanse nunha rede cristalina iónica.
-
Non conducen a electricidade en estado sólido, pero si fundidos ou disolvidos.
-
Son duros e fráxiles, funden a temperaturas elevadas.
-
Enlace covalente:
-
Únense así os átomos dos non metais.
-
Os átomos enlazados comparten parellas de electróns; cada parella compartida equivale a un enlace covalente.
-
Forman moléculas a maioría das veces.
-
Non conducen en xeral a corrente eléctrica; son pouco ou nada solubles en auga, pero si o son en disolventes orgánicos.
-
Teñen temperaturas de fusión e ebulición baixas.
-
Enlace metálico:
-
Dáse entre os átomos dos metais.
-
Xúntanse moitos átomos de metal compartindo electróns, formando unha rede cristalina con catións. Os electróns móvense entre estes catións por toda a rede metálica.
-
Conducen ben a corrente e a calor.
-
Non son duros nin fráxiles; son dúctiles e maleables.

Licenciado baixo a Licenza Creative Commons Recoñecemento Non-comercial Compartir igual 3.0