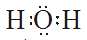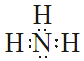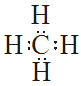2.14 Modelo de enlace covalente
Este tipo de enlace é a unión típica entre dous non metais. Tomamos como exemplo a molécula de F2. Cando dous átomos de flúor (F) se achegan, quedan enlazados. Cada átomo de flúor ten sete electróns na súa derradeira capa e os dous átomos queren capturar un electrón para completar o seu octeto. Como ningún deles vai ceder un electrón xa que o queren por igual, a única solución para ambos é compartilo:
Así, arredor de cada átomo de F móvense oito electróns (seis do átomo e dous compartidos), cumprindo a regra do octeto. Os electróns compartidos constitúen un “enlace covalente”; representámolo cun guión entre os dous átomos: F - F. Os electróns que comparte cada átomo son xusto os que lle faltan para completar o seu octeto.
Diagramas de Lewis do enlace covalente
Nestes diagramas os electróns da derradeira capa represéntanse como puntos. Os electróns compartidos debúxanse entre os dous átomos enlazados. O diagrama de Lewis da molécula anterior de gas flúor F2 sería:

Para representar estes diagramas hai que saber o número de electróns externos (na derradeira capa) dos átomos. Na seguinte táboa aparecen os elementos do segundo período indicando os electróns externos e as súas representacións de Lewis:
| Elemento | Litio | Berilio | Boro | Carbono | Nitróxeno | Osíxeno | Flúor | Neon |
| Electróns externos | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Outros diagramas de Lewis:
|
|
|
|
| Molécula de auga H2O | Molécula de amoníaco NH3 | Molécula de metano CH4 |
Licenciado baixo a Licenza Creative Commons Recoñecemento Non-comercial Compartir igual 3.0