2.2.1 Propiedades da auga
As características físicas e químicas da auga fan que sexa un líquido ideal para a vida. Trátase dun composto químico formado por hidróxeno e oxíxeno combinados en proporción de 2:1, que se atopa na natureza nomeadamente en estado líquido. A auga en estado natural non é pura, xa que no seu percorrido natural se carga dos elementos presentes nos medios que atravesa: sales minerais, materias orgánicas e microorganismos, entre outros:
- Materias disolvidas procedentes do solo: calcio, sodio, potasio, bicarbonatos, etc.
- Arxila, que forma unha esponxa absorbente susceptible de atraer bacterias e moléculas.
- Bacterias que proliferan no medio acuático.
- Materias orgánicas procedentes da descomposición de vexetais e animais.
- Po atmosférico recollido nas precipitacións.
Por iso, as augas subterráneas poden ter partículas e un olor ou un gusto desagradable, e nas augas superficiais poden proliferar bacterias polo efecto do oxíxeno e da enerxía solar.
Propiedades físicas
- Propiedades xerais: a auga pura é incolora, inodora e insípida(non ten color, olor nin sabor). Pero como vimos, totalmente pura é case imposible de atopar na natureza.
– Densidade: a da auga é de 1 kg/l, é dicir, 1 g/cm3, pero varía algo coa temperatura e coas substancias disolvidas. A densidade aumenta ao diminuír a temperatura, ata chegar aos 4 ºC (densidade máxima). Entre 4 ºC e 0 ºC a densidade diminúe e o xeo flota na auga, xa que a súa densidade de 0,91 g/cm3 é menor. Por iso, cando un lago ou o mar se conxelan, o xeo flota na superficie e illa o resto da auga, co que impide a súa conxelación e os seres vivos poden seguir vivindo por baixo do xeo.
– Calor específica: a da auga é de 1 caloría/gramo ºC, polo que cómpre achegarlle unha caloría para elevar un grao a temperatura dun gramo de auga. Esta calor é máis elevada que a doutras substancias semellantes. Por iso a auga é bo almacenador da calor, que quece e arrefría paseniño, co que axuda a regular a temperatura do planeta e dos organismos vivos, e modera o clima nas proximidades das grandes masas.
-
Substancia
Calor específica
(calorías/g ºC)

Auga
1,00
Xeo
0,55
Aceite de oliva
0,47
Aceite mineral
0,40
Gasolina
0,50
Alcohol
0,60
Glicerina
0,58
Calor específica dalgunhas substancias
As grandes masas de auga moderan o clima na súas proximidades
- Cambios de estado. A auga pódese presentar na natureza en estado sólido, líquido ou gasoso, segundo a temperatura á que se atope.
– Temperaturas de fusión e de ebulición. A temperatura de fusión da auga é de 0 ºC. Por baixo dela está en estado sólido, entre 0 ºC e 100 ºC en estado líquido e, a partir de 100 ºC, en estado gasoso. Esta temperatura recibe o nome de temperatura de ebulición.
No gráfico seguinte indícanse os posibles cambios de estado da auga. Para pasar de estado sólido a líquido ou a gasoso cómpre aumentar a temperatura, entanto que para pasar de estado gasoso a líquido ou sólido cómpre que a temperatura diminúa.
-
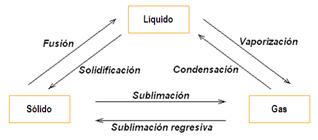
Cambios de estado
– Calor latente de fusión. É a enerxía necesaria para transformar a masa dunha substancia de estado sólido a líquido sen subir a temperatura, e varía segundo a substancia. A calor latente de fusión do xeo é de 80 calorías/gramo, valor inusualmente alto.
– Calor latente de vaporización. É a enerxía necesaria para transformar a masa dunha substancia de estado líquido a gasoso sen incrementar a súa temperatura. A calor latente de vaporización da auga é a maior de todos os líquidos, 540 calorías/gramo.
Debido á alta calor latente de vaporización, a evaporación que se produce coa transpiración da pel do ser humano e dalgúns animais ten un grande efecto de arrefriamento. Por esta mesma propiedade as plantas poden regular a súa temperatura por evaporación de auga desde a superficie das follas, que tende a quecer coa enerxía radiante do Sol.
Propiedades químicas
- Salinidade da auga. A salinidade da auga do mar ten dúas orixes: os sales arrastrados pola auga que chega ao mar desde os continentes debido ao seu gran poder disolvente, e os procedentes do magma que sae polas dorsais oceánicas dos fondos mariños.
Nun litro de auga de mar típico hai uns 35 g de sales disolvidos, a maior parte cloruro de sodio, pero a salinidade varía duns mares a outros. Nos mares pechados e con poucos ríos, como o mar Roxo ou o Mediterráneo, a salinidade é máis alta, entanto que nos mares fríos e con ríos, como o mar Báltico, a salinidade é mínima. Nalgúns mares interiores, como no mar Morto, a salinidade é altísima, con 226 g de sal por litro.
-
Proporción de sales na auga de mar
Constituínte
Símbolo
Porcentaxe en peso
-
Cloruro
Cl-
55,07
-
Sodio
Na+
30,62
-
Sulfato
SO4-
7,72
-
Magnesio
Mg++
3,68
-
Calcio
Ca++
1,17
-
Potasio
K+
1,10
-
Bicarbonato
HCO3-
0,40
-
Outros
0,24
-
– Augas duras. Nas augas doces continentais atopamos cantidades moito menores de sales. As máis abundantes son os carbonatos, os sulfatos e os cloruros de calcio, magnesio, sodio e potasio. A maior ou menor presenza de sales de calcio e de magnesio indica o grao de dureza da auga. As augas duras conteñen máis de 120 mg/litro destes sales e son propias dos terreos calcarios. Recoñécense porque é difícil conseguir que o xabón faga espuma con elas e porque producen depósitos calcarios difíciles de eliminar nas paredes dos condutos polos que circulan.
-

Depósitos calcarios debidos ás augas duras
– Augas minerais. Estas augas de consumo humano son augas subterráneas que manteñen a súa pureza orixinal, pero teñen tamén sales disolvidos en proporción variable. As de mineralización débil teñen menor proporción de sales e as augas con gas conteñen gas carbónico, que pode ser de orixe natural ou engadido artificialmente.
- Gases en disolución. A auga contén gases en disolución pero nunha proporción moi inferior á do aire. Entanto que nun litro de aire hai uns 209 ml de oxíxeno, na auga a cantidade disolvida é 25 veces menor. Outro problema é que a difusión do oxíxeno na auga é moi lenta. A turbulencia das augas, ao axitalas e mesturalas, acelera o proceso de difusión miles de veces e por iso é fundamental para a vida.
O dióxido de carbono procede da atmosfera e da respiración dos organismos, e é variable a súa concentración na auga. É necesario para a formación dos esqueletos e das cunchas de moitos invertebrados.
A temperatura tamén inflúe na solubilidade dos gases. Mentres que os sólidos se disolven mellor a temperaturas máis elevadas, cos gases sucede o contrario: as augas frías disolven mellor os gases que as augas cálidas.
Actividades propostas
S21 Indique o nome de cada un dos seguintes cambios de estado que se poden observar habitualmente nunha vivenda.
-
-
O vapor de auga que sae dunha pota a presión.
-
A formación de xeo no interior dun conxelador
-
Un cubo de xeo fundindo nun vaso de auga
-
As pingas de auga que se depositan nos azulexos do baño despois dunha ducha.
-
A formación de cubos de xeo por conxelación de auga
-
A formación dunha nube de vapor de auga ao abrirmos a porta dun conxelador.
-
S22 Que sucedería nos mares, nos ríos e nos lagos que se conxelan durante o inverno se non se producise a dilatación anómala da auga, fenómeno polo que ao baixar a temperatura de 4 ºC a 0 ºC diminúe a súa densidade en lugar de aumentar, como ocorre con outras substancias?
S23 O clima das zonas costeiras caracterízase por ser máis moderado que o das do interior: ten temperaturas máis suaves que o interior no verán e máis altas no inverno. A que cre que se debe isto? Relacióneo coas propiedades da auga.
Licenciado baixo a Licenza Creative Commons Recoñecemento Non-comercial Compartir igual 3.0