Reflexiona sobre lo que comemos
¿Has escuchado alguna vez la expresión Somos lo que comemos? Este dicho encierra una gran verdad acerca de la relación entre la alimentación y nuestra salud. Ingerimos diariamente muchos alimentos no siendo conscientes del efecto que pueden tener en nuestro bienestar corporal y a la hora de prevenir enfermedades. En ese sentido, las etiquetas alimentarias juegan un papel crucial al proporcionar información sobre los ingredientes y el contenido nutricional presentes en los productos que consumimos. Al comprender y analizar estas etiquetas, podemos tomar decisiones más informadas, elegir unos productos frente a otros, restringir el consumo de algunos y, en general, nos permite adoptar hábitos más saludables. ¡Apliquemos conocimientos de Química para interpretar esas etiquetas!
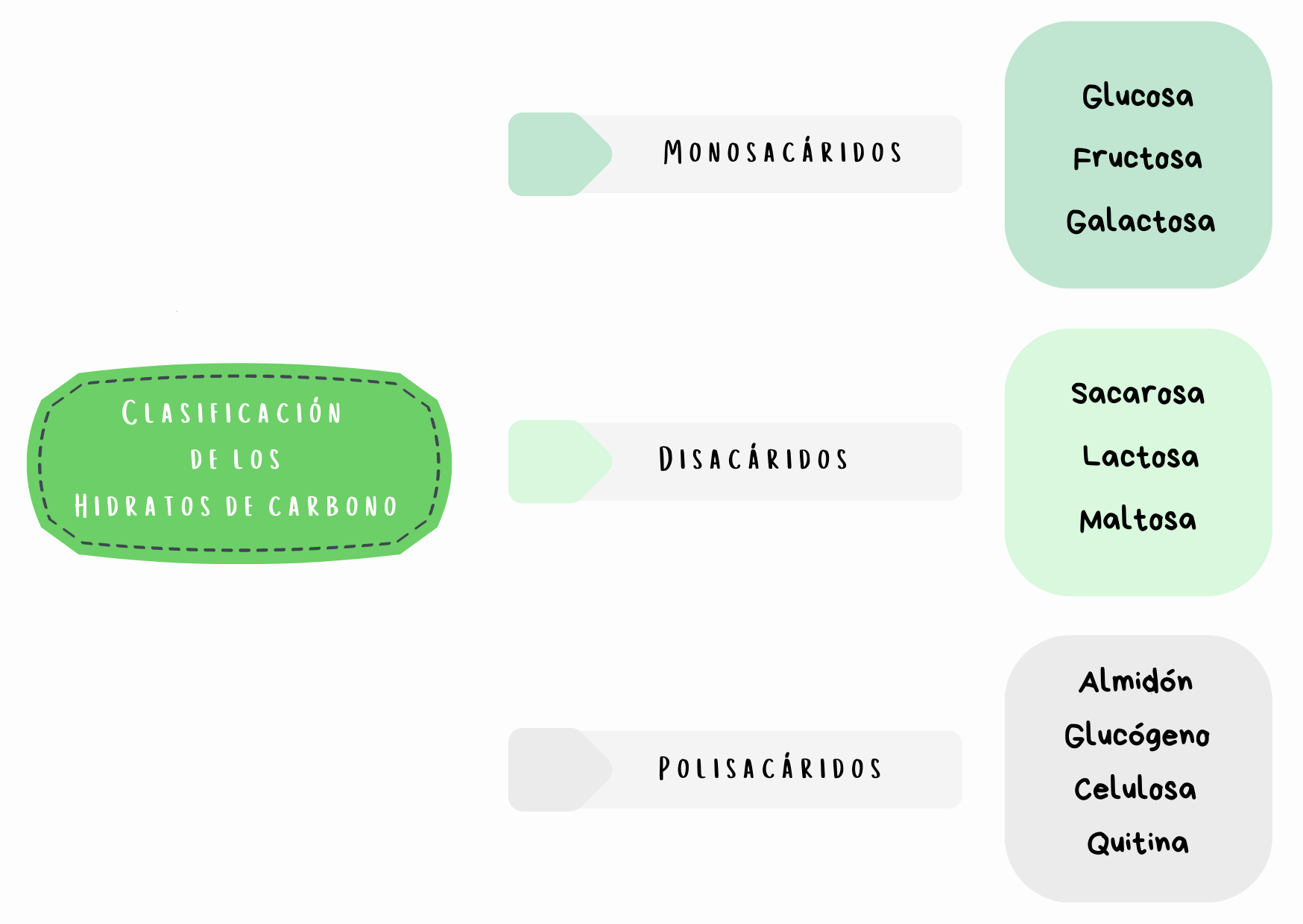
Observa los siguientes productos alimentarios. ¿Qué tienen en común? ¡Explora sus etiquetas con ayuda de la lupa!

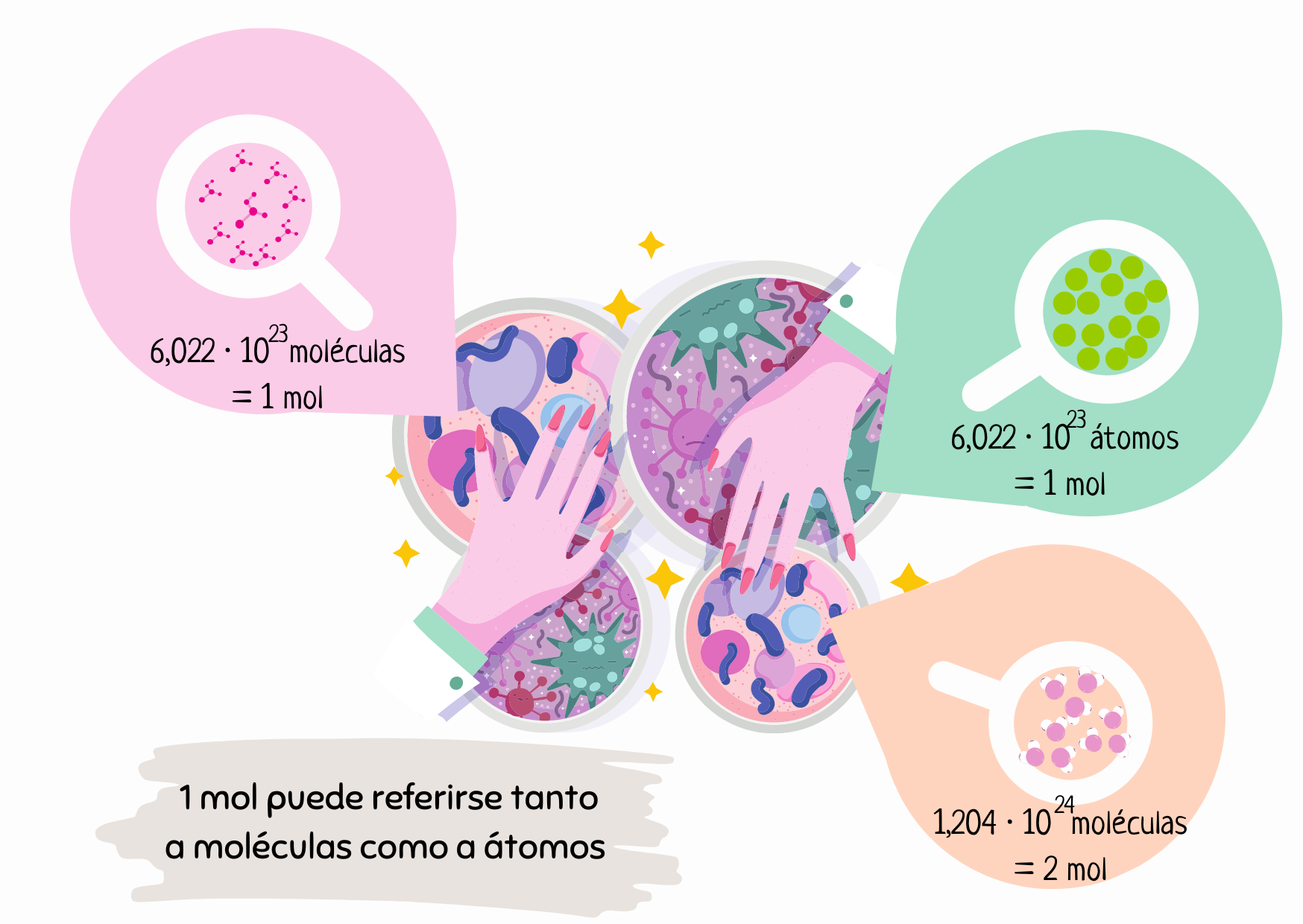
 De los anteriores conceptos, nos vamos a quedar con la masa molar como herramienta matemática para conocer cuántos mol hay en una
De los anteriores conceptos, nos vamos a quedar con la masa molar como herramienta matemática para conocer cuántos mol hay en una 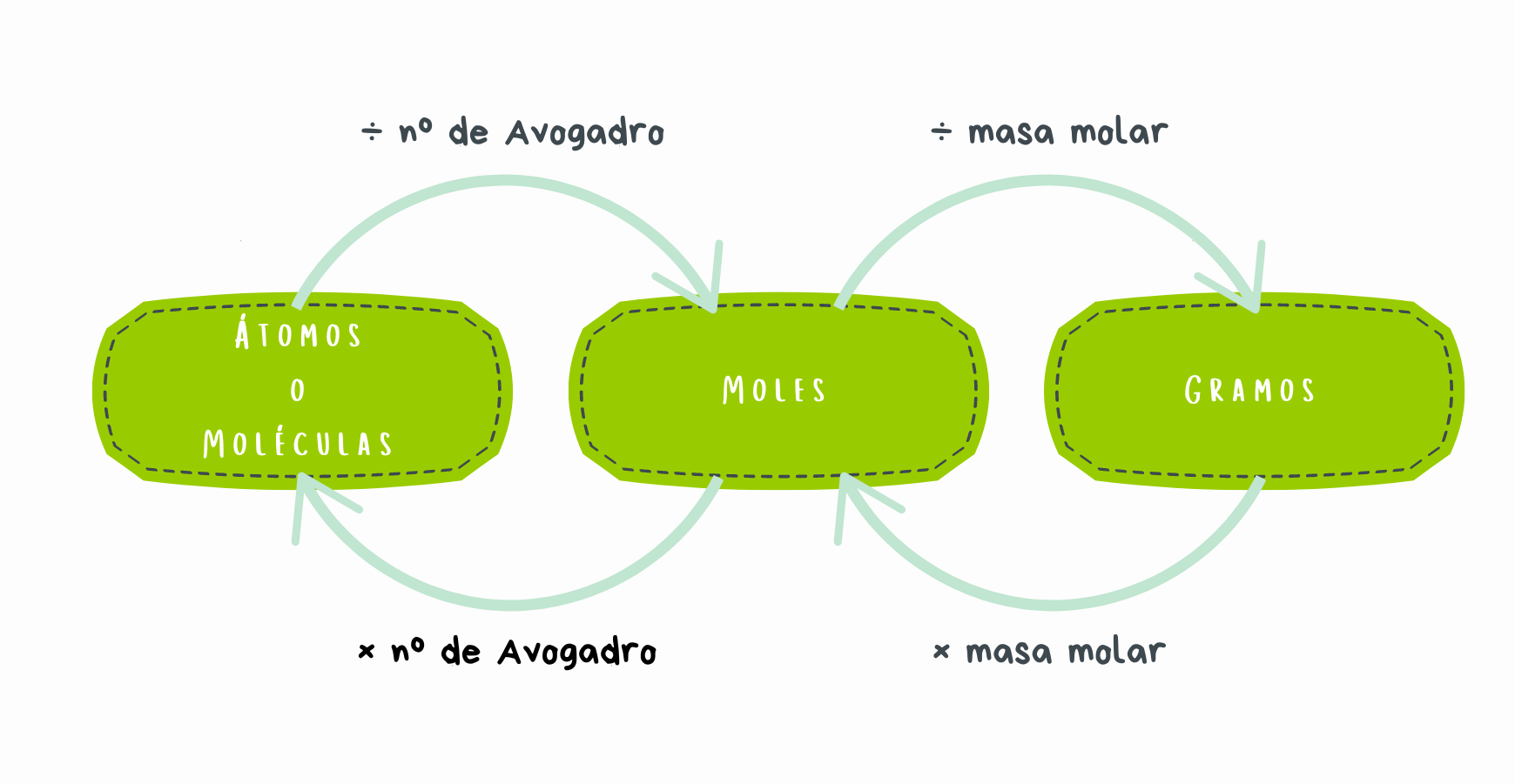
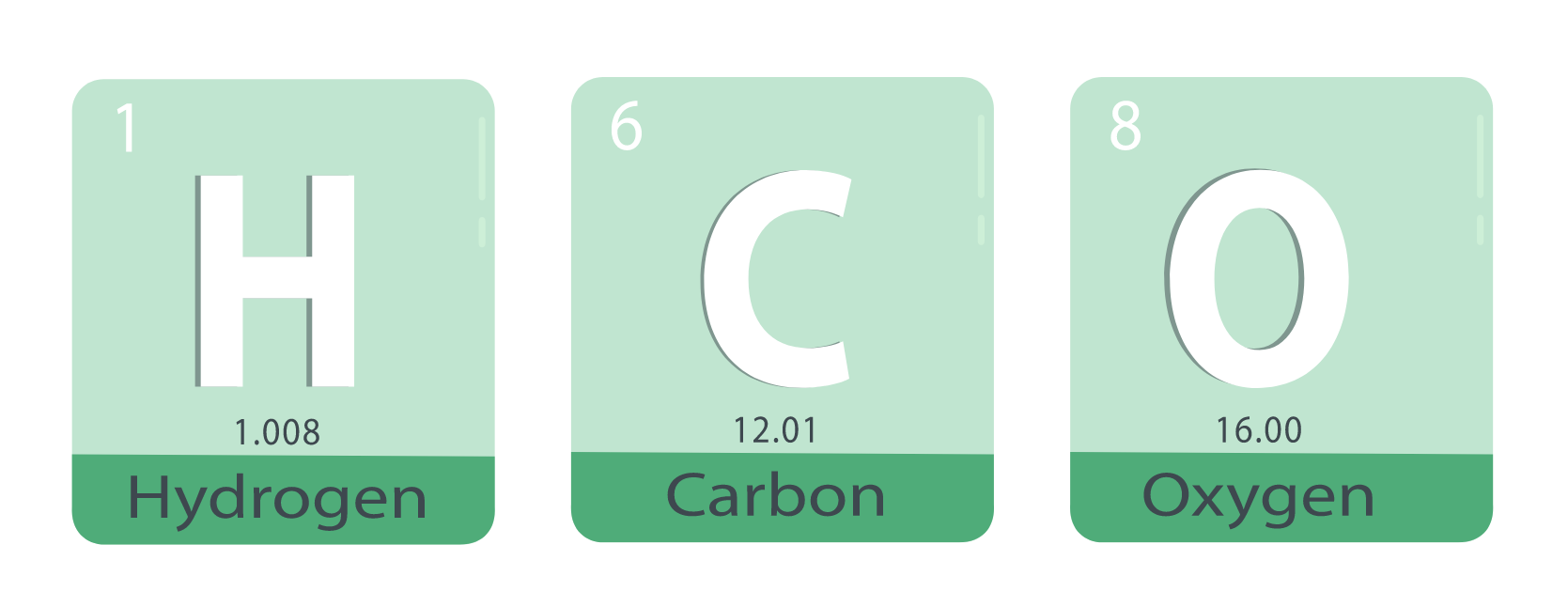
 Tomando como ejemplo la sustancia agua (H2O):
Tomando como ejemplo la sustancia agua (H2O):