CONCEPTOS PREVIOS.
-
Química do carbono
-
Fórmulas químicas.
-
Cadea carbonada.
-
Clases de átomos de carbono.
-
Isómeros.
-
Función química e grupo funcional.
-
Nomenclatura.
Os seres vivos están formados principalmente por C carbono, H hidróxeno, O osíxeno e N nitróxeno, e, en menor medida, conteñen tamén S xofre e P fósforo xunto con algúns halóxenos e metais. De aí que os compostos de carbono se coñezan co nome de compostos orgánicos (ou dos seres vivos). Pero, coidado, tamén hai moitos outros compostos de carbono que non forman parte dos seres vivos.
A parte da Química que estudia os compostos do carbono é a Química Orgánica ou Química do Carbono, pois este elemento é común a tódolos compostos orgánicos.
A Química Orgánica é a Química do Carbono. Por compostos orgánicos entendemos os compostos do carbono, agás os óxidos CO e CO2 e os carbonatos que se estudian como compostos inorgánicos dende sempre. A Química Orgánica non é só a química dos compostos dos seres vivos, son tamén os compostos derivados do petróleo, do carbón, e os preparados sinteticamente no laboratorio.
O número de compostos orgánicos coñecidos (varios millóns na actualidade) é moi superior ó de compostos inorgánicos, a pesares de ser tan poucos os elementos que entran na súa composición. A razón deste feito hai que buscala na capacidade que presenta o carbono para combinarse facilmente consigo mesmo e cos outros elementos mediante enlaces covalentes.
A configuración electrónica do carbono é:
[C]=1s2 2s2 2px1 2py1 2pz0
Dada a pouca diferencia de enerxía entre os orbitais 2s e os 2p é fácil promocionar un electrón 2s a un orbital 2p, obténdose a configuración:
[C]=1s2 2s1 2px1 2py1 2pz1
que permite a formación de catro enlaces covalentes por compartición de electróns, xa sexa consigo mesmo ou con outros elementos, gáñase así con creces a enerxía antes invertida en promocionar o electrón a un orbital superior.
O grande número de compostos orgánicos e a tremenda variedade dos seus tamaños e estructuras fai necesaria unha mínima sistematización na súa nomenclatura. A IUPAC (Unión Internacional de Química Pura e Aplicada) deseñou unhas normas que se basean fundamentalmente na utilización de prefixos que indican o número de átomos de carbono das cadeas carbonadas e sufixos para informar sobre a presencia dos diversos grupos funcionais, que se converten en prefixos específicos cando non actúan como grupo principal nos compostos polifuncionais.
Veremos máis de vagar as normas básicas de formulación das funcións orgánicas máis representativas.
Volver ó principio.
A fórmula química é a forma escrita dunha molécula. Debe proporcionar, como mínimo, dúas informacións importantes: que elementos forman o composto e en que proporción se atopan ditos elementos no mesmo.
A fórmula pode ser:
Empírica:
É a fórmula máis simple posible. Indica que elementos forman a molécula e en que proporción están. É a fórmula que se obtén a partir da composición centesimal dun composto. Por exemplo, se temos un hidrocarburo (formado por H e C) podemos combustionalo en presencia de osíxeno, e a partir do CO2 e H2O que se forman determinar a cantidade de C e H que contén. Bastará calcular os moles de C e H, e dividir estas dúas cantidades polo valor máis pequeno determinamos a proporción dos átomos no composto, é dicir, a súa fórmula empírica.
Exemplo : CH, composto formado por carbono e hidróxeno, na proporción: 1 a 1.
Molecular:
Indica o número total de átomos de cada elemento na molécula. Para coñecer a fórmula molecular a partir da empírica é preciso coñecer a masa molecular do composto. A partir das propiedades coligativas, como presión osmótica, descenso crioscópico ou aumento ebuloscópico, podemos determinar a masa molecular, e a partir desta a fórmula molecular cunha simple proporción.
Hai tres formas distintas de escribir unha fórmula molecular:
| Condensada | Expresa o tipo e número de átomos da molécula. Pero non informa dos enlaces que presenta a mesma. | Exemplo : C6H6 composto formado por seis átomos de carbono e seis átomos de hidróxeno. |
| Semidesenvolvida | Nela represéntanse só os enlaces carbono-carbono. | Exemplo: HC º CH presenta un enlace triple carbono-carbono. |
| Desenvolvida ou Estructural | Represéntanse tódolos enlaces da molécula. |
Exemplo: H - C º C - H Na maior parte dos casos bastará coa fórmula semidesenvolvida. |
Xeométricas:
Abrevian a escritura e indican a distribución dos átomos no plano ou no espacio.
| Planas |
en lugar de CH3 - CH2 - CH2 -CH2 -CH2 -CH2 -CH2 -CH3 |
| Tridimensionais |

As cuñas e liñas descontinuas pretenden axudar a dar perspectiva á molécula. COOH e H están no plano. OH está detrás do plano. CH3 está diante do plano. |
Volver ó principio.
É a secuencia de átomos de carbono, unidos entre si, que forman o esqueleto da molécula orgánica.
Hai diferentes tipos de cadea, segundo sexa a súa forma:
Aberta ou acíclica: Os átomos de carbono extremos non están unidos entre si. Non forman aneles ou ciclos.
Pode ser:
| Lineal | Non levan ningún tipo de substitución. Os átomos de carbono poden escribirse en liña recta. Anque tamén se poden escribir retorcidas para ocupar menor espacio. É importante saber ver que anque estea torcida é unha cadea lineal. |  |
| Ramificada | Dalgún dos carbonos da cadea lineal sae outra ou outras cadeas secundarias ou ramas. | 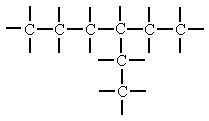 |
Pechada ou cíclica: O último carbono da cadea únese ó primeiro, formando un ciclo ou anel.
Hai varios tipos:
| Homocíclica | Os átomos do ciclo son átomos de carbono. |
| Heterocíclica | Algún átomo de carbono do ciclo foi substituído por outro átomo, por exemplo N, S, O, etc. |
| Monocíclica | Só hai un ciclo. |
| Policíclica | Hai varios ciclos unidos. |
Volver ó principio.
| Primario | Un carbono é primario se está unido só a un átomo de carbono. | 
Os dous átomos de carbono son primarios |
| Secundario | Se está unido a dous átomos de carbono. | 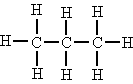
O átomo de carbono central é secundario. |
| Terciario | Se está unido a tres átomos de carbono. | 
O átomo de carbono (3) é terciario. |
| Cuaternario | Se está unido a catro átomos de carbono. | 
O átomo de carbono (3) é cuaternario. |
Volver ó principio.
Chámanse isómeros a dous ou máis compostos diferentes que teñen a mesma fórmula molecular, pero diferente fórmula estructural, e diferentes propiedades físicas ou químicas.
|
Estructural: Os isómeros diferencianse pola orde na que están enlazados os átomos na molécula. |
||
| Isomería de cadea: Distinta colocación dalgúns átomos na cadea. |  |
|
| Isomería de posición: Distinta posición do grupo funcional. | ||
| Isomería de función: Distinto grupo funcional. | ||
|
Estereoisomería: Os isómeros diferencianse pola disposición tridimensional dos átomos na molécula. |
||
| Isomería xeométrica ou cis-trans:propia dos compostos con dobres enlaces. |  |
 |
| Isomería óptica: propia de compostos con carbonos asimétricos, é dicir, cos catro substituíntes diferentes. |  |
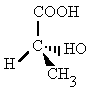 |
Volver ó principio.
Chámase función química a cada grupo de compostos con propiedades e comportamentos químicos característicos.
Cada función caracterízase por posuír un agregado, dun ou varios átomos, ó que se denomina grupo funcional.
As funcións químicas que imos formular, cos seus grupos funcionais, están na seguinte táboa.
Volver ó principio.
É o conxunto de regras que permiten asignar, univocamente, un nome a cada composto químico.
Nomenclatura sistemática
É a que se axusta a un sistema prefixado.
Débense seguir os convenios establecidos pola I.U.P.A.C. (Unión Internacional de Química Pura e Aplicada).
Nomenclatura tradicional
Arraigada na linguaxe química convencional, aínda que non segue unhas normas prefixadas.
Moitos destes nomes tradicionais están aceptados pola IUPAC.
|
Exemplos |
Nome sistemático | Nome tradicional |
| eteno | etileno | |
| etino | acetileno | |
| triclorometano | cloroformo | |
| ácido etanodioico |
ácido oxálico |
|
 |
metilbenceno | tolueno |