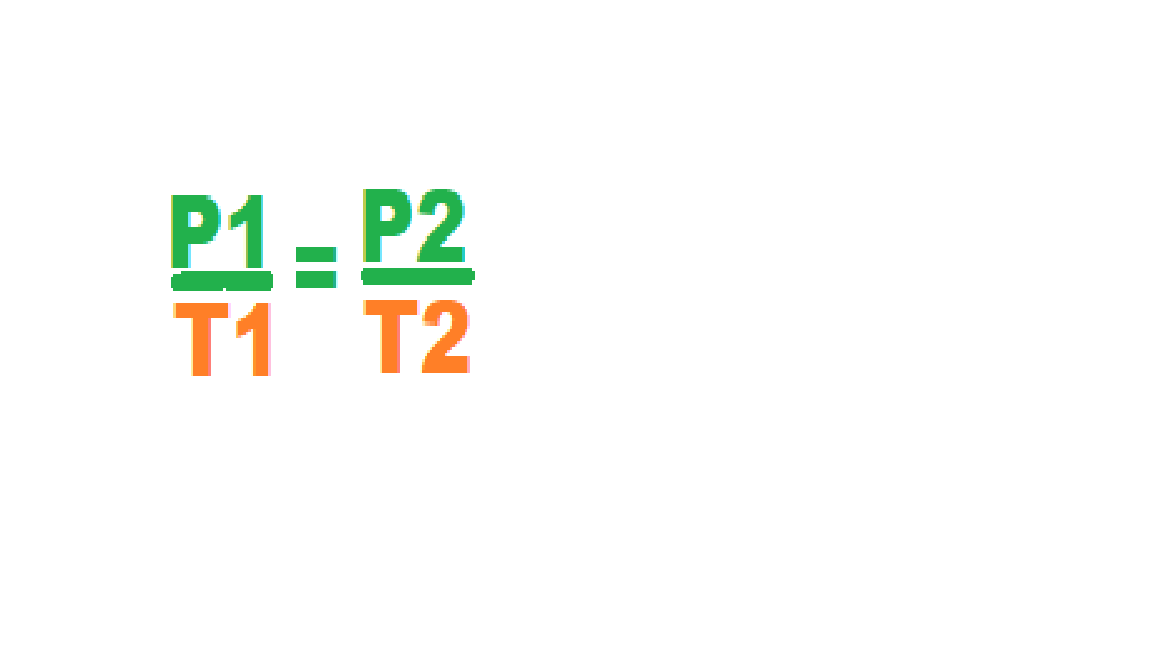Joseph-Louis Gay- Lussac
Joseph- Louis Gay-Lussac (Saint-Léonard-de-Noblat , 6 de decembro de 1778, París 9 de maio de 1850) foi un físico e químico francés. É coñecido polo seu estudo dos gases e formulación da lei que leva o seu nome, e tamén polo estudo da composición elemental da auga e a creación dunha escala da medida da graduación alcoólica.
Joseph-Louis Gay-Lussac was a French chemist and physicist. He is known mostly for his discovery that water is made of two parts hydrogen and one part oxygen (with Alexander von Humboldt), for two laws related to gases, and for his work on acohol-water mixtures, which led to the degrees Gay- Lussac used to measure alcoholic beverages in many countries.

Wikimedia commons