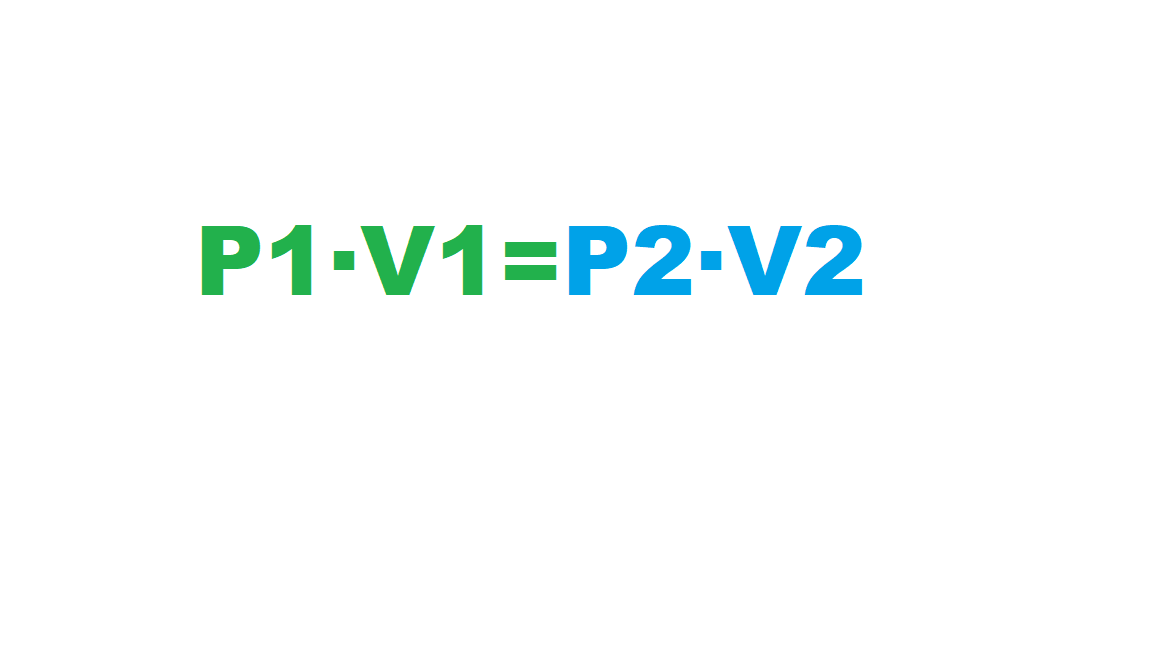ROBERT BOYLE (25 xaneiro 1627-31 decembro 1691)
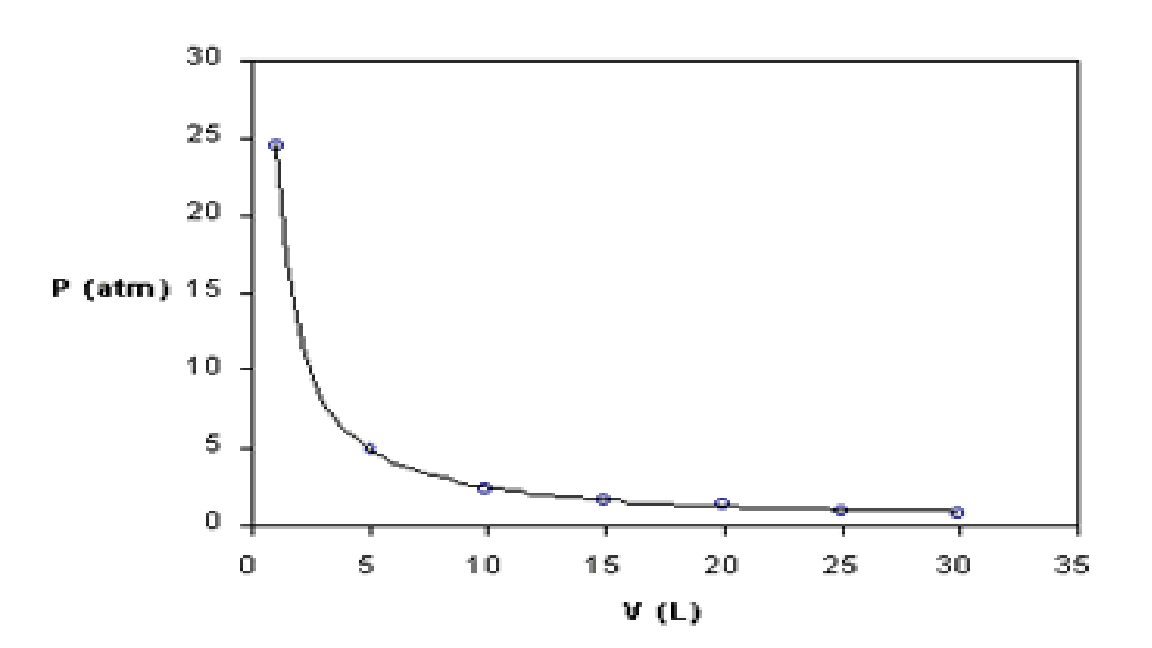
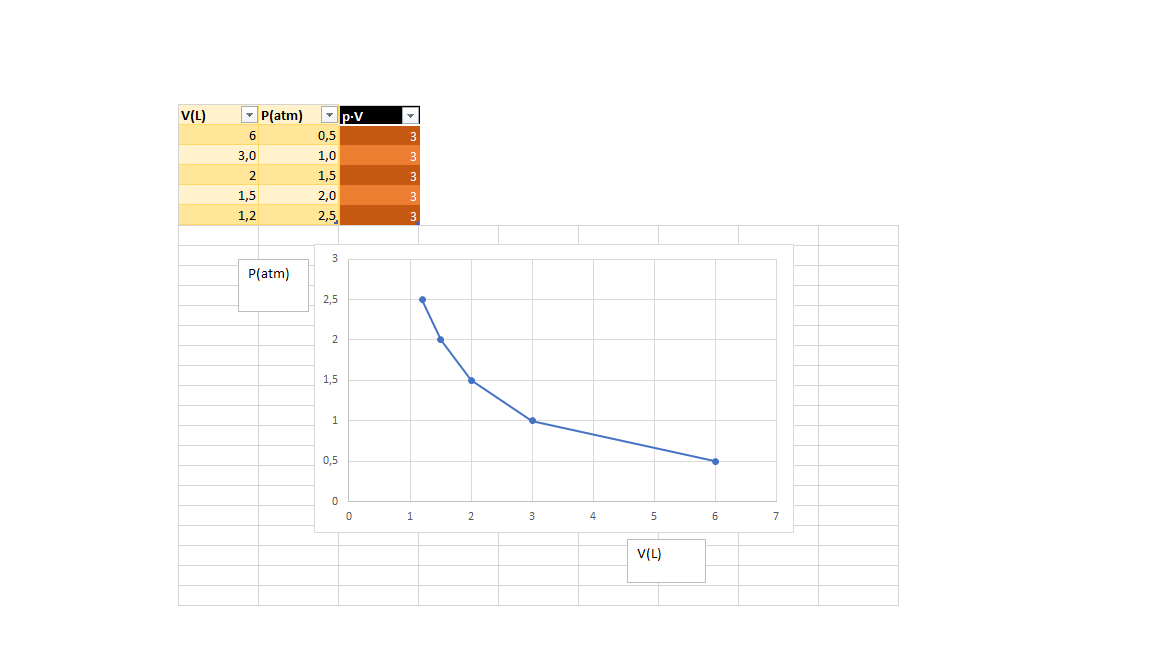
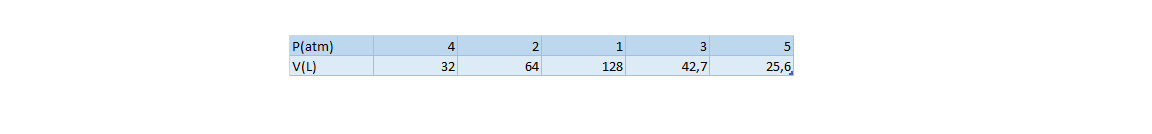
Boyle foi un filósofo natural, químico, físico e inventor anglo-irlandés. É considerado o primeiro químico moderno, e por tanto uns dos fundadores da química moderna, e uns dos pioneiros do método científico experimental. Realizou grandes contribucións no estudio dos gases coa formulación da lei de Boyle. Tamén foi un renombrado teólogo.
ROBERT BOYLE (25 January 1627-31 December 1691)
Boyle was an Anglo-Irish natural philosopher, chemist, physicist and inventor. Boyle is largely regarded today as the first modern chemist, and therefore one of the founders of modern chemistry, and one of the pioneers of modern experimental scientific method. He made great advances in the understanding of gases behaviour. He also was noted by his writings in theology.

Portrait of the honourable Robert Boyle. Wikimedia commons. CC BY