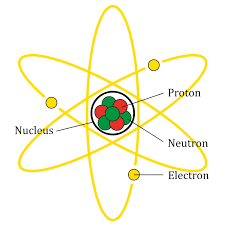
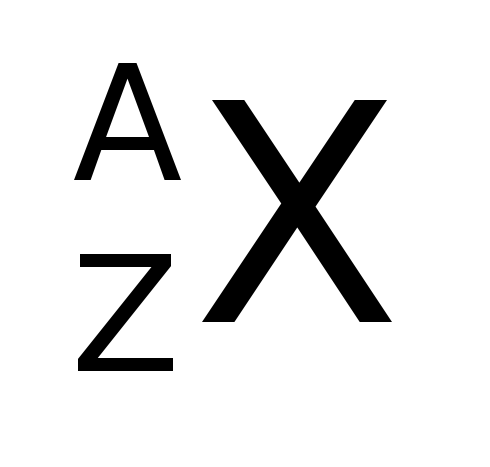In ancient Greece, the philosophers Leucippus and Democritus believed that matter was made of small particles and therefore could not be divided indefinitely.. They thought there had to be an inseparable or indestructible block. They called these particles atoms, which means "indivisible".
This idea was put aside by scientists until 1808, when John Dalton formulated the hypothesis that matter was composed of elemental units that could not be altered or divided. He also called them atoms.
Nowadays, with the help of special microscopes, we can see individual atoms and even interact with them.
TRADUCIÓN
Na antiga Grecia, os filósofos Leucipo e Demócrito crían que a materia estaba feita de pequenas partículas e polo tanto non podía ser dividida indefinidamente. Pensaban que tiña que haber un bloque indestrutible e inseparable. Chamaron a estas partículas átomos, que significa "indivisible".
Esta idea foi deixada de lado polos científicos ata 1808, cando John Dalton formulou a hipótese de que a materia estaba composta de unidades elementais que non podían ser alteradas ou divididas. Tamén os chamou átomos.
Na actualidade, coa axuda de microscopios especiais, podemos ver átomos individuais e incluso interaccionar con eles.